| ДОМ | МЕНЮ | ДОКИ | ПОИСК |
Обзор публикации
Полную электронную версию данной статьи на английском языке можно найти в Интернете по адресу:
http://www.regenmedres.com/content/2/1/6
Сердце человека имеет ограниченную способность к регенерации, что делает репаративной ответ после инфаркта миокарда довольно сложной задачей. В течение последнего десятилетия, стволовые клетки стали перспективными кандидатами для сердца ремонт, из-за их мощного потенциала дифференцировки и паракринной секреции цитокинов. Среди различных типов стволовых клеток, мезенхимальных стволовых клеток имеют высокий пролиферативный потенциал и секретируют множество цитокинов, факторов роста и микроРНК. Паракринные цитокины играют важную роль в регенерации сердца, неоваскуляризации, анти-апоптоза, и механизмах борьбы с ремоделированием, среди других. В обзоре представлены цитокины, выделяемые стволовых клеток и их относительных сигнальных путей, которые представляют собой ключевые механизмы регенерации сердца и может служить в качестве перспективного будущего терапевтической стратегии для пациентов, перенесших инфаркт миокарда.
Ключевые слова:
Цитокины, регенерация сердца, стволовые клетки, паракринные механизмы.

Введение
Инфаркт миокарда (ИМ) приводит к потере сердечной ткани и образования рубца, что в конечном итоге привести к сердечной недостаточности. По данным Всемирной организации здравоохранения, сердечная недостаточность по инициативе ИМ и счетов ИБС на 29% смертей по всему миру [ 1 ]. Тем не менее, человек сердечная ткань не восстанавливается спонтанно, таким образом, "регенеративная медицина" представляет собой многообещающую альтернативу лечения ИМ [ 2 ]. Сердечная ткань регенеративная медицина включает в себя регенерацию кардиомиоцитов, образование новых сосудов, и паракринные цитокины, которые обладают противовоспалительным, антиапоптотического и анти-ремоделирования эффекты [ 3 ]. В течение последнего десятилетия, стволовые клетки стали перспективными кандидатами для регенеративной медицины не только из-за их способности дифференциации по отношению к кардиомиоцитов и клеток сосудов линий, но и их способности к извлечению такие паракринные факторов и их антиаритмические эффекты [ 4 , 5 ]. Паракринные цитокины и хемокины играют основные роли в клеточных механизмов, связанных с сердечной мышцей.
Несмотря на огромные успехи были достигнуты в выявлении новых стратегий, чтобы сохранить миокарда и улучшения смертности больных ИМ, дальнейшего понимания воздействия цитокинов на миобластов дифференциации и связанные с ними сигнальных путей может обеспечить уникальные возможности для сокращения сердечная патология.
Настоящий обзор обобщает клеток, связанных с цитокинами стволовых клеток и связанных с ними репаративные пути, которые представляют собой потенциальные терапевтические мишени для регенерации сердца после инфаркта миокарда. (см. Массаж при сердечной недостаточности)
Сотовые источники регенерации сердца
Сердечные клетки-предшественники
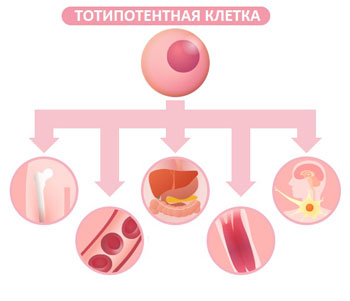
Вскоре после рождения, кардиомиоцитов человека прекратить размножение и обладают очень ограниченное регенеративную способность. Тем не менее, эта концепция была поставлена ??под сомнение в последнее время. Bergmann др. б C 14 на сегодняшний день углерода ДНК деления кардиомиоцитов. Они показали, что диплоидные ядра кардиомиоцитов были моложе, чем человеческих субъектов, обеспечивая хорошее свидетельство кардиомиоцитов разделения у взрослых людей. Математическая статистика предположил, что примерно 1% кардиомиоцитов были возобновлены в год в возрасте 20 лет и 0,4% в возрасте 75 лет [ 6 ]. Основываясь на этих кинетики, около 45% кардиомиоцитов можно было бы предсказать быть продлен по сравнению с нормальным человеческой жизни, в то время как 55% будут клетки, сохраняющиеся с момента рождения. В женском сердце, оборот миоцитов происходит со скоростью 10%, 14% и 40% в год в 20, 60 и 100 лет соответственно [ 7 ]. После этой демонстрации способности восстановления у взрослых сердечной ткани, наличие клеток-предшественников сердечных (CPC) в постнатальном сердца Сообщалось различными группами [ 8 ]. Цены за клик были определены поверхностных маркеров, таких как, например, с-KIT, Isl1 клеток, или SCA-1 и их физиологических свойств, таких как способность к оттоку флуоресцентный краситель (то есть, сторона населения) [ 9 ]. Цены за клик, экспрессирующие рецептор с-KIT тирозин-киназы являются наиболее изученным подтип [ 10 ]. Бельтрами и др. была впервые идентифицирована C-KIT-положительным CSCs в центре, способные деления симметрично и асимметрично в пробирке и дифференцироваться в миоциты, гладкомышечных клеток сосудов (СМЦ), и эндотелиальных клеток (EC) [ 11 ]. Недавно дифференцированные кардиомиоциты обладают механическими и электрическими свойствами функционально кардиомиоциты, которые улучшают сердечную функцию после инфаркта миокарда [ 12 ]. Некоторые исследования показывают, что при трансплантации, с-KIT + клетки вызывают масштабное восстановление инфарктов миокарда и способствовать формированию нового миокарда и сосудов, в то время как другие полагают, меньшего масштаба регенерации [ 10 ]. Hatzistergos и его коллеги показали, что МСК может стимулировать эндогенные CSCs, в том числе C-KIT CSCs и GATA-4 CSCs, дифференцироваться в обогащенных популяциях взрослых cardioblasts, которые экспрессируют Nkx2-5 и тропонина I, как в естественных условиях и в пробирке [ 13 ]. Однако клинические приложения ЦОНов ограничены из-за их малочисленности и низкой пропускной способностью распространения. Тем не менее, ЦОНы играют ключевую роль в поддержании сердечной гомеостаза и ремонта.
Мезенхимальные стволовые клетки
С первого демонстрации того, что из костного мозга мезенхимальные стволовые клетки (МСК) может генерировать функциональные кардиомиоциты [ 14 ], эти клетки стали перспективным кандидатом для терапевтического болезни сердца. В последнее десятилетие многие клинические испытания использовали МСК для лечения ИМ и сердечной недостаточности. Результаты показали клинической эффективности и безопасности, но улучшение сердечной функции были ограничены, в пределах от 3% до 15% [ 15 ]. В настоящее время дифференциация МСК в функциональные кардиомиоциты остается спорным и скорость регенерации миокарда появляется слишком незначительны, чтобы объяснить значительное восстановление сердечной функции наблюдается после трансплантации MSC следующей ИМ. Накопленные данные показывают, что профиль MSC цитокинов оказывает благотворное влияние на предотвращение апоптоза и фиброза, а также улучшение функции сердца [ 16 - 18 ]. Например, Дюран и др. Недавно показано, что костного мозга стволовые клетки улучшить выживаемость, сердечную функцию и ослаблять реконструкции через секрецию про-ангиогенных факторов, которые стимулируют образование новых сосудов эндогенного [ 5 ].
Индуцированные плюрипотентные стволовые клетки
Пятнадцать лет назад, Мерри и др. Первый показал, что фибробласты могут быть transdifferentiated в скелетных мышцах в пробирке с гиперэкспрессией миогенных транскрипционный фактор, MyoD [ 19 ]. Впоследствии, Яманака и его коллеги доказали, что плюрипотентные стволовые клетки могут быть вызваны из эмбриональных мыши или взрослых фибробластов, вводя четыре определенные факторы, Oct3 / 4, Sox2, с-Myc, и KLF4, в условиях культуры клеток эмбриональных стволовых [ 20 ]. Хотя это инновационная находка открыла захватывающая область исследования, его клинического применения остаются ограниченными, учитывая трансгенных интеграции и изменения эндогенной геномной организации. Индуцированные плюрипотентные стволовые клетки (IPS) могут дифференцироваться в кардиомиоциты с помощью механизмов с участием вышеупомянутых цитокинов. Производство ИПС по невирусных методов или комбинации цитокинов может служить альтернативой для клеточной терапии IPS.
В условиях гипоксии, стволовые клетки могут выпустить факторы роста и цитокины, такие как трансформирующий фактор роста (TGF) -β, интерлейкин (IL) -6, фактора роста эндотелия сосудов (VEGF), фактор роста фибробластов (FGF) -2, фактор роста гепатоцитов (HGF), инсулиноподобный фактор роста (ИФР), ангиопоэтин (Ang) -1, стромальных клеток, полученных фактор (SDF) -1, матриксной металлопротеиназы (ММР) -9, и фактор некроза опухоли (ФНО) -α, среди др. Эти секретируемые цитокины оказывают важные анти-апоптоза, противовоспалительное и анти-ремоделирования эффекты в паракринным способом [ 21 ].
Цитокины, стволовые клетки, и регенерация кардиомиоцитов
Цитокины представляют собой небольшие мобильные секретируемых молекул, которые играют основные роли в клеточной пролиферации, дифференцировки и апоптоза [ 22 ]. Повышение данные свидетельствуют о том, что трансплантации стволовых клеток может уменьшить циркулирующих воспалительных цитокинов, таких как TNF-α, IL-6, и IL-1β в ответ на повреждение. Аггарваль и др. отметил, что иммунные клетки культивируют совместно с MSC, может изменить профиль секреции цитокинов и, наконец, привести к immunotolerance в пробирке [ 23 ]. Среди кандидатов на положительных регуляторов кардиомиоцитов дифференциации, в TGF-β, IL-6, и хемокинов семей наиболее широко исследованы до настоящего времени и было продемонстрировано, что ключевыми игроками в регенерации кардиомиоцитов. (см. ИТ в медицине)
TGF-β и регенерации кардиомиоцитов
Данио сердце показывает замечательную способность к регенерации по сравнению с сердца млекопитающих. TGF-β экспрессируется во время раннего развития сердца у рыбок данио, которая координирует широкий спектр последующих клеточных шагов, которые необходимы для эффективного регенерации сердца. Недавно было сообщено, что Smad3 в зависимости от сигналов TGF-β организует благотворное воздействие на кардиомиоциты на основе регенерации для достижения полной регенерации сердца [ 24 ]. Подавление TGF-β сигналов / активин вызвало широкий ассортимент сотовых фенотипы, влияющих на функцию сердца. В ИМ, TGF-β играет ключевую роль в репарации сердца, подавляя воспаление и содействие миофибробластов фенотип и внеклеточного матрикса осаждения. Миофибробластного пролиферативности по восстановлению сердечной функции после инфаркта миокарда. Кроме того, TGF-β одновременно индуцированного миогенез и ингибирует адипогенез в зависимости от дозы [ 25 ]. В MI, TGF-β была активируется особенно в пограничной зоне инфаркта, связанного с Smad2, 3, 4 и экспрессию и фосфорилирование Smad1 и 2 [ 26 ]. TGF-β1 может вызвать МСК дифференцироваться в любой хондроцитов или ГМК в пробирке [ 27 , 28 ]. TGF-β освобожден от МСК может стимулировать ангиогенез, стимулируя пролиферацию EC. Тем не менее, клетки - клетки и - матрицы взаимодействия необходимы для такой дифференциации происходит, похоже на развитие этих тканей в естественных условиях [ 29 ]. TGF-β1 ингибирует Adipogenic дифференциацию МСК в однослойной культуре. В последнее время, Рухи др. показали, что аутологичной сыворотки усиливает дифференцировку кардиомиоцитов крысы костного мозга МСК клеток в присутствии TGF-β1 [ 30 ]. Взятые вместе, сигнальный путь TGF-β1 может служить в качестве потенциального терапевтической мишени для процесса регенерации сердца.
IL-6, семейства цитокинов и регенерации кардиомиоцитов
Накопление данные показывают, что семья IL-6 также играет ключевую регуляторную роль в регенерации кардиомиоцитов. Семейство IL-6, включает ингибирующий лейкоз фактор (LIF), кардиотрофином-1 (СТ-1), IL-6, онкостатина-М, и neutrotrophin-1 / В-клеточным стимулирующим фактором-3 (NNT-1 / BSF-3 ) [ 31 , 32 ]. IL-6 имеет многочисленные мероприятия. На клетках-мишенях, ИЛ-6 связывается с 80 кДа IL-6-рецептора (IL-6R), связанного со вторым белком, gp130, и инициирует внутриклеточную передачу сигнала [ 33 ]. IL-6 имеет несколько регуляторных функций иммунной и нервной систем. Кроме того, IL-6, также участвует в регенерации печени и метаболического гомеостаза [ 34 ]. Экзогенный рекомбинантный IL-6 влияет пролиферации и дифференцировки культивируемых миобластов, полученных из человека или мыши мышцы с помощью активации пути STAT3 сигнализации [ 35 ]. Наша группа недавно показали, что IL-6 экспрессия и активация STAT3 сигнального пути в моноцитов / макрофагов являются важнейшими медиаторами миграции макрофагов и миобластов пролиферации во время регенерации мышц [ 36 ].
СТ-1 является еще одним членом семейства цитокинов IL-6. CT-1 нокдаун не влияет инфаркта размер в мышиной модели, предполагая, что КТ-1 не играет существенную роль в МИ-связанной травмы. Повышающая регуляция СТ-1 в инфаркта миокарда модулирует фиброзную реакцию путем ингибирования пролиферации фибробластов [ 37 ]. Тем не менее, CT-л активирует Janus киназы / преобразователи сигналов и активаторов транскрипции (ЯК / STAT), митоген-активированный протеин (MAP) киназы, фосфатидилинозит (PI) 3-киназы, и ядерный фактор ?B (NF-kB) путей оказывать его гипертрофированные и цитозащитные свойства [ 38 ].
Хемокинов и регенерации сердца
Хемокины содержать семью маленьких, очень основных белков с поразительно похожи третичной структуры [ 39 ]. Хемокины заметно активируется в лечебных инфарктов миокарда и играют важную роль в модуляции инфаркта ангиогенез и отложение фиброзной ткани. В хемокинов СХС подсемейства, SDF-1α / СХС-хемокинов типа рецептора 4 (SDF-1α / CXCR4) ось является наиболее понимать сигнальный путь для кардиогенеза, неоваскуляризации, кроветворения, и развития нейронов, а также эндотелиальных клеток-предшественников оборот , SDF-1 преимущественно экспрессируется в области инфаркта после инфаркта миокарда, который вызывает миграцию МСК в сердце и может, ответственного за улучшение сердечной функции [ 40 ]. Ранее мы показали, что эндотелиальные синтазы окиси азота (Енос) способствует миграции МСК по направлению к infracted сердце через усилением активности SDF-1 [ 41 ]. Тем не менее, это SDF-1 - индуцированная МСК миграция в сторону области М. И. почти могут быть отменены по PI3K ингибитора и CXCR4 антагониста [ 40 ]. Избыточная экспрессия SDF-1 в МСК способствовали ангиогенез и улучшение сердечной функции у крыс М. модели [ 42 ].
Цитокины, неоваскуляризация, и ангиогенез
MI вызывает воспаление в инфаркта зоны и накопление различных факторов, которые способствуют процессу ангиогенеза. Лай и др. показали, что MSC-полученные микрочастицы увеличить миоцитов жизнеспособность и снижения негативного ремоделирования после инфаркта гипоксии, вызванной травмой [ 43 ]. Эти микрочастицы было продемонстрировано, содержат цитокины, хемокины и микроРНК. Неоваскуляризации состоит из двух окружных процессов, васкулогенезе и ангиогенеза. Васкулогенез управляется из костного мозга циркулирующих эндотелиальных клеток-предшественников, тогда как ангиогенез инициируется локальной ЭК пролиферирующих из существующей сосудистой сети. Неоваскуляризации в строго регулируется различными цитокинами, в том числе VEGF, FGF, и Ang семей [ 44 ]. Здесь мы приводим основные цитокины, которые играют основные роли в новых сосудов и ангиогенеза.
VEGF
VEGF играет решающую роль в пролиферации ЕС и найма, эмбрионального развития, и ишемического повреждения тканей. VEGF действует через VEGF рецептор (VEGFR) 1 или VEGFR 2 Протеинтирозинкиназы. Гипоксия-индуцируемый фактор (HIF) -1 является ключевым регулятором экспрессии VEGF [ 45 , 46 ].Пять человека VEGF изоформ (A, B, C, D, и плацентарный фактор роста [PlGF]) были произведены с помощью дифференциального сплайсинга VEGF мРНК. VEFG-в основном занимается роста сосудов, лимфатической развития, и сосудистой мальформации[ 47 ]. Таким образом, VEGF-интенсивно исследуется в отношении его роли в туморогенеза и потенциал для лечения рака. В то время как VEGF-C и VEGF-D регулировать лимфангиогенез [ 48 ]. VEGF-видимому, критическим регулятором пролиферации ЕС [ 49 ]. Предварительная обработка сердечных шрамы переноса генов VEGF в дополнение к Gata4, MEF2C и Tbx5 (GMT) усиливается трансдифференцировку крысы фибробластов в (индуцированных) кардиомиоцитов [ 50 ]. Добавление VEGF в трансфекции коктейль привело к 4-кратному повышению фракции сердечного выброса [ 50 ].Недавно Е. и др. показали, что VEGF необходим для эффективного кардиомиоцитов дифференциации человеческих IPS [ 51 ]. Кроме того, VEGF также является посредником фосфорилирования Енос, который играет важнейшую роль в регуляции ангиобластов и эмбрионального распространения ЕС [ 52 ]. Взятые вместе, VEGF является ключевым регулятором ангиогенеза после ишемии сердца и требует дальнейшего расследования в терапевтической мишени для гипоксии, вызванной повреждением тканей в последующих клинических испытаний.
FGF
Семейство FGF белок проявляет широкий спектр эффектов. Среди этих белков, кислую FGF (FGF-1) и основной FGF (FGF-2) являются наиболее важными стимуляторами пролиферации EC и продвижения ангиогенеза при раке и сердечной гипоксии [ 53 ].FGF активируется в ранние сроки после ишемического повреждения сердца, что свидетельствует о том, что он может быть вовлечен в регуляцию ранней воспалительной реакции после ИМ. Хотя FGF и VEGF активировать различные гены и, кажется, стимулируют различные типы судов, эти действия сильно коррелируют [ 54 ]. Было показано, что эффекты кровеносных сосудов FGF являются зависимыми VEGF, в то время как VEGF-индуцированной тубулогенеза требуется FGF сигналов [ 55 ]. FGF, как было показано, чтобы вызвать образование новых сосудов в модели крысы ножке сосудистой [ 56 ]. Эндотелиальных клеток-предшественников выразить FGF-рецепторы, и было показано, что FGF регулирует пролиферацию и дифференцировку клеток, как МСК эндотелиальных предшественников через пути ERK1 / 2 сигнализации [ 57 ]. В мышиной модели диабета, улучшение неоваскуляризации соответствует высокой локальной экспрессии FGF и VEGF, предполагая, что эти цитокины играют ключевую роль в пост-ишемической ангиогенеза. (см. Оценка функции сердечно-сосудистой системы)
Недавно было также установлено, что МСК гиперэкспрессией гранулоцитов хемотактическую белок (GCP) -2 улучшенную функцию сердца за счет расширения кровеносных сосудов свойств в инфаркт модели инфаркта [ 58 ]. Взятые вместе, кровеносных сосудов, цитокины, секретируемые МСК представляют перспективные терапевтические мишени для лечения больных ИМ.
Цитокинов и других кардиопротекторные эффекты
Цитокины, секретируемые МСК также играют важную роль в кардиомиоциты апоптоза, сердечной сократимости, ремоделирования сердца и воспаления.
Антиапоптотического эффекты
Mirotsou и др. Сообщается, что секретируется прожарен-белок, связанный с 2 (sFRP2) способствует миокарда ремонт за счет увеличения клеточного катенин и повышающей регуляции экспрессии антиапоптотических генов Birc1b и bcl2 [ 59 ]. Ван и др. продемонстрировали, что Hsp20-инженерии МСК устойчивы к окислительному стрессу в результате усиленной активации Akt и повышенной секреции VEGF, FGF-2, и IGF-1 [ 60 ]. МСК, предварительно обработанные с комбинацией факторов роста, в том числе FGF-2, IGF-1, и БМП-2, привести к снижению кардиомиоцитов апоптоз в условиях гипоксии и повышению фосфорилирования Akt и циклического аденозинмонофосфата (цАМФ), в результате чего более щелевых и уменьшение размера инфаркта [ 61 ].
Антиаритмические эффекты
Антиаритмического потенциал МСК остается спорным. Чанг и др. показал Proarrhythmic потенциал трансплантации MSC в лабораторной системе сокультуры [ 62 ].Такие Proarrhythmic эффекты могут быть связаны с неоднородностью МСК, незрелости transdifferentiated МСК, и сократительной дискинезии между МСК и наземных кардиомиоцитов. Тем не менее, Ли и др. утверждают, что стволовые клетки терапия способствует важные антиаритмические эффекты при правильном применении [ 63 ].Таким образом, исследования по вопросу о последствиях MSC-связанных цитокинов на аритмии требуют дальнейшего оценки. В антиаритмические эффекты МСК может служить более важные клинические приложения, чем антиаритмических препаратов.
Противовоспалительные эффекты
После повреждения миокарда, несколько врожденные иммунные пути активируются в инфаркта миокарда. Воспалительные факторы, такие как TGF-β, IL-1β, IL-6, TNF-α, VEGF, а другие последовательно найдены в области инфаркта. Аггарваль и др. отмечено, что оборот MSC в области инфаркта снижает секрецию TNF-α и интерферона-γ, в то время как увеличение ИЛ-4 и ИЛ-10 производства [ 23 ]. Трансплантации MSC также ослабление активности NF-kB, ингибирует продукцию белка TNF-α и IL-6, и увеличивает экспрессию IL-10 в инфаркта миокарда [ 64 ]. МСК также выпустит гемоксигеназы-1 (HO-1) и Енос, важные антиоксидантные стрессовые факторы, в результате защиты кардиомиоцитов, улучшение неоваскуляризации и улучшение сердечной функции на ранней стадии после инфаркта миокарда [ 65 ]. Механизмы, посредством которых МСК модулируют иммунную систему уменьшает воспалительный ордер ответ дальнейшего расследования.
Регенерации миокарда интенсивно изучается в последнее десятилетие, учитывая перспективные результаты клеточной терапии ИМ. Среди механизмов, лежащих в основе кардиопротективные эффекты стволовых клеток, паракринной цитокины, выпущенные стволовых клеток являются наиболее важными факторами. В этом обзоре суммированы основные цитокины, вовлеченные в кардиомиоцитов дифференциации, ангиогенез, и неоваскуляризации, а также анти-апоптотических и антиаритмических процессов. Более глубокое понимание кардиопротекторными механизмов МСК и IPS может позволить открытие более выгодных цитокинов для регенерации сердца. Полное понимание соответствующих путей цитокинов сигнализации и их сложных биологических эффектов будет иметь важное значение для будущих клинических применений.
Доступна английская версия статьи здесь
Полную электронную версию данной статьи на английском языке можно найти в Интернете по адресу:
http://www.regenmedres.com/content/2/1/6
<< Назад: Научно-популярная информация из области клонирования и стволовых клеток
Рекомендуем Вам посмотреть популярные разделы сайта myvaleology.com: MENU с описанием разделов | |||
| СОЦСЕТИ | ВКЛАД | ДИЕТА | СПОРТ |
|
|
Версия all4-8 |
||
Copyright © VZOJ 2023. Все права защищены. При перепечатке или цитировании материалов сайта myvaleology.com, пожалуйста, ставьте ссылку на сайт myvaleology.com :
<a href="https://myvaleology.com">Здоровый образ жизни</a>
Права на фотографии принадлежат их авторам.
Сайт работает на хостинге www.reg.ru , скидка на услуги по промокоду 5084-7F0E-EABE-D693
В партнерстве со www.onlinetrade.ru (Вы сразу получаете 300 Бонусов на покупки при регистрации, 1 Бонус = 1 Рубль)